1. Modelo Atómico de Dalton
1. “Toda matéria é composta por minúsculas partículas chamadas átomos”.
2. “Átomos de diferentes elementos apresentam massa e propriedades diferentes”.
3. “Átomos são permanentes e indivisíveis, não podendo ser criados e nem destruídos”.
4. “As reações químicas correspondem a uma reorganização de átomos”.
2. Modelo Atómico de Thomson
Esse foi o primeiro modelo a divisibilidade do átomo, ficando o modelo conhecido como “pudim de passas". Segundo Thomson, o átomo seria um aglomerado composto de uma parte de partículas positivas pesadas (protões) e de partículas negativas (eletrões), mais leves.
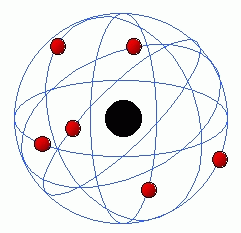
3. Modelo Atómico de Rutherford:
4. Modelo Atómico de Bohr:
O cientista Niels Bohr, completou o modelo atómico de Rutherfrod, com as seguintes ideias:
- os eletrões, que são partículas do átomo com carga negativa, movem-se à volta do núcleo em órbitas circulares, tal como fazem os planetas à volta do
sol no sistema solar;
- a cada órbita corresponde um determinado nível de energia;
- os eletrões que possuem mais energia movem-se em órbitas mais afastadas do centro, isto é, do núcleo, e os eletrões com menos energia encontram-se a circular em órbitas perto do núcleo do átomo.
5. Modelo Atómico Atual:
Actualmente foi posta de parte a ideia das órbitas circulares à volta do núcleo para os eletrões. Hoje, defende-se a ideia que os eletrões dos átomos movem-se de forma desconhecida e com uma velocidade elevadíssima, formando uma nuvem que foi designada por: nuvem eletrónica.
A nuvem eletrónica é mais densa no centro, isto é perto do núclo, onde é mais provável ser encontrado um eletrão e menos densa longe do núclo, onde é mais improvável ser encontrado um eletrão.