A constituição da matéria é motivo de muita curiosidade entre os povos antigos. Filósofos procuram há tempos a constituição dos materiais. Os modelos atómicos surgiram devido a essa curiosidade, e o seu resultado implicou na descoberta do fogo, o que o permitiu cozinhar os alimentos, e consequentemente implicou em grande desenvolvimento para a sociedade. Para isso os cientistas baseavam-se nas obsersações das experiências que realizavam para criar essas imagens representativas, imagens essas que foram mudando ao londo do tempo:
1. Modelo Atómico de Dalton

No século XIX, o professor inglês John Dalton disse que:
1. “Toda matéria é composta por minúsculas partículas chamadas átomos”.
2. “Átomos de diferentes elementos apresentam massa e propriedades diferentes”.
3. “Átomos são permanentes e indivisíveis, não podendo ser criados e nem destruídos”.
4. “As reações químicas correspondem a uma reorganização de átomos”.
2. Modelo Atómico de Thomson
Nos finais do século XIX, Joseph Thomson, baseando-se em algumas experiencias e pesquizas sobre raios catódicos, propôs um novo modelo atômico. Thomson demonstrou que esses raios podiam ser interpretados como sendo um feixe de partículas carregadas de energia elétrica negativa. A essas partículas denominou-se eletrões. Por meio de campos magnético e elétrico pôde-se determinar a relação carga/massa do eletrão.
Esse foi o primeiro modelo a divisibilidade do átomo, ficando o modelo conhecido como “pudim de passas". Segundo Thomson, o átomo seria um aglomerado composto de uma parte de partículas positivas pesadas (protões) e de partículas negativas (eletrões), mais leves.
3. Modelo Atómico de Rutherford:
O cientista neozelandês Ernest Rutherford, recorrendo à realização de uma esperiência, que consistia no bombardeamento com particulas numa lâmina de ouro (tendo cerca de 10000 átomos de espessura), permitiu-lhe concluir que a maior parte dos átomos era espaço vazio e no interior desse mesmo átomo, existia uma zona central com carga positiva, onde estaria concentrada toda a massa do mesmo. Deste modo Ernest Rutherford imaginou os átomos constituidos por um núcleo de pequenas dimensões, com carga positiva, onde se concentra a massa geral do átomo e por electrões com carga elétrica negativa que se movimentam à volta do núcleo. Assim surgiu o primeiro planetário do átomo (séc. XX).
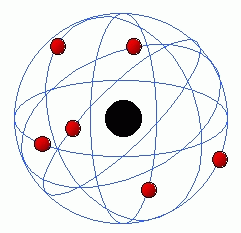
4. Modelo Atómico de Bohr:
O cientista Niels Bohr, completou o modelo atómico de Rutherfrod, com as seguintes ideias:
- os eletrões, que são partículas do átomo com carga negativa, movem-se à volta do núcleo em órbitas circulares, tal como fazem os planetas à volta do
sol no sistema solar;
- a cada órbita corresponde um determinado nível de energia;
- os eletrões que possuem mais energia movem-se em órbitas mais afastadas do centro, isto é, do núcleo, e os eletrões com menos energia encontram-se a circular em órbitas perto do núcleo do átomo.
5. Modelo Atómico Atual:
Actualmente foi posta de parte a ideia das órbitas circulares à volta do núcleo para os eletrões. Hoje, defende-se a ideia que os eletrões dos átomos movem-se de forma desconhecida e com uma velocidade elevadíssima, formando uma nuvem que foi designada por: nuvem eletrónica.
A nuvem eletrónica é mais densa no centro, isto é perto do núclo, onde é mais provável ser encontrado um eletrão e menos densa longe do núclo, onde é mais improvável ser encontrado um eletrão.